הטבלה המחזורית, המכונה גם הטבלה המחזורית של היסודות, היא סידור מאורגן של 118 היסודות הכימיים הידועים. היסודות הכימיים מסודרים משמאל לימין ומלמעלה למטה לפי סדר העלייה במספר האטומי, או מספר הפרוטונים בהגרעין של, אשר בדרך כלל עולה בקנה אחד עם הגדלת המסה האטומית.
ארגון הטבלה המחזורית מספק מידע חשוב על מבנה ותכונותיו של אלמנט. המשך לקרוא כדי ללמוד עוד על האופן שבו נוצרה הטבלה המחזורית לפני למעלה מ-150 שנה ומדוע משתמשים בה כיום.
קָשׁוּר:
מי יצר את הטבלה המחזורית?
דמיטרי מנדלייב, כימאי וממציא רוסי, נחשב ל"אבא" של הטבלה המחזורית, על פיהחברה המלכותית לכימיה. בשנות ה-60 היה מנדלייב מרצה פופולרי באוניברסיטה בסנט פטרסבורג, רוסיה. באותה תקופה לא היו קיימים ספרי לימוד מודרניים לכימיה אורגנית בשפה הרוסית, אז מנדלייב החליט לכתוב אחד. בזמן שעבד על הספר ההוא, שכותרתו "עקרונות הכימיה" (שני כרכים, 1868–1870), הוא התמודד במקביל עם בעיית היסודות המופרעים, לפיאקדמיית חאן.
לעשות סדר באלמנטים יהיה קשה למדי. באותו זמן, היו 63 יסודות כימיים ידועים, שלכל אחד מהם משקל אטומי מחושב באמצעות ההשערה של אבוגדרו, הקובעת שנפחים שווים של גזים, כאשר הם שומרים על אותו זמן.ולחץ, להחזיק את אותו מספר של מולקולות.
רק שתי אסטרטגיות היו קיימות באותה תקופה כדי לסווג את היסודות הללו: הפרדתם למתכות ולא-מתכות או קיבוץ אותם לפי מספר האלקטרונים הערכיים של יסוד (האלקטרונים בקליפה החיצונית ביותר). החלק הראשון בספרו של מנדלייב עסק רק בשמונה מהיסודות הידועים - פחמן, מימן, חמצן, חנקן, כלור, פלואור, ברום ויוד - ושתי האסטרטגיות הללו פעלו עבור היסודות המסוימים האלה, לפי מייקל ד' גורדין בספרו. "דבר מסודר היטב: דמיטרי מנדלייב והצל של הטבלה המחזורית" (הוצאת אוניברסיטת פרינסטון, מהדורה מתוקנת 2018). אבל הם לא הספיקו כדי למיין בצורה מועילה את 55 היסודות הכימיים הנוספים הידועים באותה תקופה.

אז לפי ההחברה המלכותית לכימיה, מנדלייב כתב את המאפיינים של כל יסוד בקלפים והחל לסדר אותם על ידי הגדלת המשקל האטומי. זה כאשר הבחין בקורלציה בין משקל אטומי לתכונות כימיות.
עם זאת, המדויק "אאוריקה!" הרגע שהוביל את מנדלייב לאסטרטגיית המיון של הטבלה המחזורית השלמה עדיין אפוף מסתורין. "קשה ביותר לשחזר את התהליך שבו הגיע מנדלייב לארגון היסודות התקופתי שלו במונחים של משקלם האטומי", כתב גורדין על הטבלה המחזורית המלאה. "הבעיה מנקודת המבט של ההיסטוריון היא שבעוד שמנדלייב שמר כמעט כל מסמך וטיוטה שעברו את ידיו לאחר שהאמין שהוא יתפרסם, הוא לא עשה זאת לפני ניסוח החוק התקופתי".
גורדין המשיך, "ישנן שתי דרכים בסיסיות שבהן מנדלייב יכול היה לעבור מהכרה בחשיבותו של משקל אטומי ככלי סיווג טוב לטיוטה של מערכת מחזורית: או שהוא כתב את היסודות לפי סדר המשקל האטומי בשורות, הבחין בחזרה תקופתית או שהוא הרכיב כמה 'קבוצות טבעיות' של יסודות, כמו הלוגנים ומתכות אלקליות, והבחין בדפוס של משקל הולך וגדל." ההצהרה הידועה היחידה של מנדלייב שהייתה קשורה לשיטתו הגיעה באפריל 1869; הוא כתב שהוא "אסף את הגופים בעלי המשקל האטומי הנמוך ביותר והציב אותם לפי סדר העלייה שלהם במשקל האטומי", לפי ספרו של גורדין.
לא משנה מה תהליך החשיבה שלו, מנדלייב סידר בסופו של דבר את היסודות לפי משקל אטומי וגם לפי אלקטרוני ערכיות. לא רק שהוא השאיר מקום ליסודות שטרם התגלו, אלא שהוא חזה את התכונות של חמישה מהיסודות הללו ואת התרכובות שלהם. במרץ 1869, הוא הציג את הממצאים בפני החברה הרוסית לכימיה. מאוחר יותר באותה שנה פורסמה המערכת התקופתית החדשה שלו כתקציר בכתב העת הגרמני לכימיהכתב עת לכימיה(Journal of Chemistry), על פי האוניברסיטת קליפורניה, סן דייגו.

קריאת הטבלה המחזורית
הטבלה המחזורית מכילה כמות עצומה של מידע, אך חלק מהחשובים ביותר הם מספרים אטומיים, סמלים אטומיים ומסות אטומיות.
מספר אטומי:מספר הפרוטונים בגרעין האטום מכונה המספר האטומי של אותו יסוד. מספר הפרוטונים מגדיר באיזה יסוד מדובר וקובע את התנהגותו הכימית. לְדוּגמָה,תמיד יש שישה פרוטונים;תמיד יש אחד; ותמיד יש שמונה. גרסאות שונות של אותו יסוד, הנקראים איזוטופים, יכולים להיות בעלי מספר שונה של נויטרונים. יסודות יכולים גם לצבור או לאבד אלקטרונים כדי להיטען, ובמקרה זה הם נקראים יונים.
סמל אטומי:הסמל האטומי (או סמל היסוד) הוא קיצור שנבחר לייצג יסוד ("C" עבור פחמן, "H" עבור מימן ו-"O" עבור חמצן וכו'). סמלים אלה נמצאים בשימוש בינלאומי ולעתים הם בלתי צפויים. לדוגמה, הסמל עבורהוא "W" כי שם אחר לאלמנט זה הוא wolfram. הסמל האטומי לזהב הוא "Au" מכיוון שהמילה לזהב בלטינית היא "aurum".
מסה אטומית:המשקל האטומי הסטנדרטי של יסוד הוא המסה הממוצעת של היסוד הכתובה ביחידות מסה אטומית (אמו). למרות שלכל אטום יש בערך מספר שלם של יחידות מסה אטומית, תבחין שהמסה האטומית בטבלה המחזורית היא עשרונית; זה בגלל שהמספר הוא ממוצע משוקלל של האיזוטופים השונים המתרחשים באופן טבעי של יסוד על סמך השפע שלהם.
המסה האטומית של יסודות מסוימים מעשה ידי אדם היא קצת יותר מסובכת. ליסודות 93-118, שהם יסודות טרנס-אורניום שנוצרו במעבדה (יסודות מעבר לאורניום, שמספרו האטומי של 92), אין שפע "טבעי", לפיהמעבדה הלאומית של לוס אלמוס (LANL). עם יסודות אלה, המשקל האטומי של האיזוטופ בעל החיים הארוך ביותר מופיע בטבלה המחזורית, על פי האיגוד הבינלאומי לכימיה טהורה ויישומית (IUPAC). משקלים אטומיים אלה צריכים להיחשב זמניים, מכיוון שאיזוטופ חדש עם זמן מחצית חיים ארוך יותר (כמה זמן לוקח 50% מהיסוד להתפרק) יכול להיווצר בעתיד, על פיLANL.
היסודות העל-כבדים, או אלה עם מספרים אטומיים מעל 104, מתאימים גם הם לקטגוריה הלא טבעית הזו. ככל שגרעין האטום גדול יותר - שגדל עם מספר הפרוטונים שבתוכו - כך היסוד לא יציב יותר, בדרך כלל. ככאלה, האלמנטים הגדולים האלה הם חולפים, ונמשכים אלפיות שניות בלבד לפני שהם מתפרקים לאלמנטים קלים יותר, על פי IUPAC. לדוגמה, יסודות העל כבדים 113, 115, 117 ו-118 היובדצמבר 2015, והשלים את השורה השביעית, או התקופה, בטבלה. מספר מעבדות שונות ייצרו את האלמנטים הסופר-כבדים. המספרים האטומיים, השמות הזמניים והשמות הרשמיים הם:
- 113: מתוך אחד (Uut),(Nh)
- 115: ununpentium (Uup),(מק)
- 117: ununseptium (חדש),(Ts)
- 118: לילה אחד (Uuo),(וגם)
כיצד מסודרת הטבלה המחזורית?
הלפי משקל אטומי ואלקטרוני ערכיות. משתנים אלו אפשרו למנדלייב למקם כל אלמנט בשורה מסוימת (הנקראת נקודה) ובעמודה (הנקראת קבוצה). הטבלה כוללת שבע שורות ושמונה עשרה עמודות.
המספר של כל שורה, או נקודה, מציין את מספר האורביטלים של היסודות באותה שורה, לפיהמעבדה הלאומית של לוס אלמוס. (לאטומים יש פרוטונים ונייטרונים בגרעין שלהם, ומסביב זה, האלקטרונים שלהם מסודרים באורביטלים., אורביטלים מתארים את מיקומו של האלקטרון וכן את התנהגותו דמוית הגל.) כלומר כל היסודות בתקופה השלישית - נתרן, מגנזיום, אלומיניום, סיליקון, זרחן, גופרית, כלור וארגון - יש שלושה אורביטלים אטומיים שבהם שוכנים האלקטרונים שלהם.
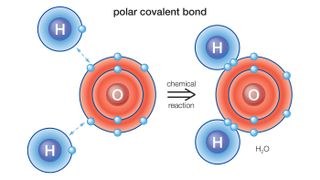
העמודה, או הקבוצה, מציינת את מספר האלקטרונים בקליפה החיצונית ביותר של האטום; אלה נקראים האלקטרונים הערכיים, והם האלקטרונים שיכולים ליצור קשר כימי עם אלקטרוני ערכיות של יסודות אחרים. האלקטרונים הערכיים יכולים להיות משותפים עם אלמנט אחר, בקשר קוולנטי, או להחליף באמצעות קשר יוני, לפיאוניברסיטת פרדו.
כדוגמה, ליסודות בקבוצה 8A (או VIIIA) לכולם יש קבוצה מלאה של שמונה אלקטרונים במסלול בעל האנרגיה הגבוהה ביותר, כתב הכימאי וויליאם ראוש בדף האינטרנט שלו בכתובתאוניברסיטת מישיגן סטייט. ליסודות התופסים את אותה עמודה בטבלה המחזורית (הנקראת "קבוצה") יש תצורות אלקטרוניות ערכיות זהות, וכתוצאה מכך מתנהגים בצורה דומה מבחינה כימית. לדוגמה, כל היסודות מקבוצת 18 הם גזים אינרטיים, כלומר הם אינם מגיבים עם אלמנטים אחרים.
ישנם כמה חריגים לכלל זה ברכיבי המעבר, הממלאים את העמודות הקצרות יותר במרכז הטבלה המחזורית. ליסודות המעבר הללו יש מלאים חלקית ד-אורביטלים, התורמים לתכונות הייחודיות שלהם. זה מבדיל אותם מהאלמנטים העיקריים של הקבוצה שממלאים בעיקר s- ו-p-אורביטלים.
בואו ננסה דוגמה: אנחנו יכולים לבחור, שיש לו מספר אטומי של 34, כלומר יש 34 אלקטרונים בסך הכל באטום נייטרלי של סלניום. לא מתכת זו שוכנת בתקופה 4, קבוצה 6A. זה אומר שסלניום שומר את האלקטרונים שלו בארבעה אורביטלים אטומיים, ויש לו שישה אלקטרונים ערכיים, או שישה אלקטרונים במסלול החיצוני ביותר שלו. אתה יכול גם להבין כמה אלקטרונים יש באורביטלים הראשון, השני והשלישי שלו: האורביטל הראשון יכול להכיל מקסימום שני אלקטרונים, בעוד שלשני יש ארבעה תת-אורביטלים ולכן יכול להכיל בסך הכל שמונה אלקטרונים. הקליפה השלישית של אטום, המורכבת מתשעה תת-אורביטלים, יכולה להכיל מקסימום 18 אלקטרונים, לפיהמחלקה לכימיה וביוכימיה של אוניברסיטת פלורידה. זה אומר שלסלניום יש 2, 8, 18 ו-6 אלקטרונים במסלול האטומי הראשון, השני, השלישי והרביעי שלו, בהתאמה.
אבולוציה של הטבלה המחזורית
כאשר מנדלייב פרסם לראשונה את הטבלה המחזורית המקורית ב-1869, היא הכילה רק 63 יסודות - בערך מחצית ממה שיש היום. בשולחן שלו היו פערים כדי להשאיר מקום לאלמנטים שעדיין לא התגלו, ולמנדליהשתמש במיקום הפערים הללו כדי לחזות את המאפיינים של אלמנטים חדשים פוטנציאליים. דוגמה אחת לכך היא מה שמנדלייב כינה "eka-aluminium", אלמנט מוצע בעל תכונות דומות לאלומיניום. כמה שנים מאוחר יותר, אלמנט זה זוהה כגליום, ומאפייניו אושרו כדומים מאוד לתחזיותיו של מנדלייב.
מאז המאה ה-19, מספר היסודות הידועים כמעט הוכפל. אותם יסודות שהתגלו לאחרונה השלימו לאט לאט את החסר בעיצובו המקורי של מנדלייב והרחיבו את הטבלה למספרים אטומיים גבוהים עוד יותר. כל הפערים מולאו רשמית בטבלה המחזורית ב-שנות ה-2010לאחר הסינתזה של אלמנט 117,טנסין.
תיאורטית זה אפשרילהרחיב את הטבלה המחזורית עוד יותרככל שהכימאים מסנתזים יסודות כבדים יותר ויותר, כך ייתכן שהטבלה המחזורית לעולם לא תהיה שלמה. אלמנטים אלה מעשה ידי אדם נוצרים באמצעות מאיצי חלקיקיםלרסק יחד אטומים וחלקיקים תת-אטומיים, יצירת גרעינים עם פרוטונים וניטרונים נוספים. עם זאת, האלמנטים הכבדים במיוחד הללו הם מאוד לא יציבים וקשים להכנה. "אנחנו באמת לא יודעים מהו האלמנט הכבד ביותר שיכול להתקיים",ויטולד נצרביץ',פיזיקאי גרעיני מאוניברסיטת מישיגן סטייט, אמר למגזין Smithsonian.
כיצד משתמשים בטבלה המחזורית כיום?
על ידי הידיעה שלאלמנטים מסוימים שמקובצים יחד על השולחן יש מאפיינים והתנהגויות מסוימות, מדענים יכולים להבין אילו מהם יהיו הטובים ביותר עבור תעשיות ותהליכים מסוימים. לדוגמה, מהנדסים משתמשים בשילובים שונים של יסודות בקבוצות III ו-V של הטבלה כדי ליצור סגסוגות מוליכים למחצה חדשות, כגון גליום ניטריד (GaN) ואינדיום ניטריד (InN), לפיהמכון הלאומי לתקנים וטכנולוגיה(NIST).
באופן כללי, כימאים ומדענים אחרים יכולים להשתמש בטבלה כדי לחזות כיצד יסודות מסוימים יגיבו זה עם זה. המתכות האלקליות, למשל, נמצאות בעמודה או בקבוצה הראשונה של הטבלה והן נוטות להיות בעלות אלקטרון ערכיות אחד ולכן נושאות מטען של +1. מטען זה אומר שהם "מגיבים במרץ עם מים ומתחברים בקלות עם לא מתכות", כתבה הכימאית אן מארי הלמנסטיןThoughtCo.מגנזיום, שנמצא באותה קבוצה על השולחן כמו סידן, הופך שימושי כחלק מסגסוגות להשתלות עצם, אמר NIST. מכיוון שהסגסוגות הללו מתכלות, הן משמשות כפיגום ואז נעלמות לאחר שעצם טבעית צומחת על המבנים.
למעלה ממאה שנה לאחר יצירתה, הטבלה המחזורית נותרה אחד הכלים הקריטיים ביותר במדע, המספקת מסגרת להבנת אבני הבניין של החומר. זה לא רק מארגן את כל האלמנטים הידועים למבנה קוהרנטי, אלא גם משמש כמפת דרכים לניבוי וסינתזה של יסודות חדשים והנחיית חדשנות כימית.
דיווח נוסף מאת Traci Pedersen, תורמת ל- Live Science